La heteromerización interclase afecta la localización y el tráfico intracelular de los receptores acoplados a proteínas G (GPCRs).
Rudy Toneatti , Jong M Shin, Urjita H Shah, Carl R Mayer, Justin M Saunders , Miguel Fribourg , Paul T Arsenovic , William G Janssen , Stuart C Sealfon , Juan F López-Giménez, Deanna L Benson, Daniel E Conway, Javier González-Maeso.
Science Signaling. 2020 Oct 20
RESUMEN
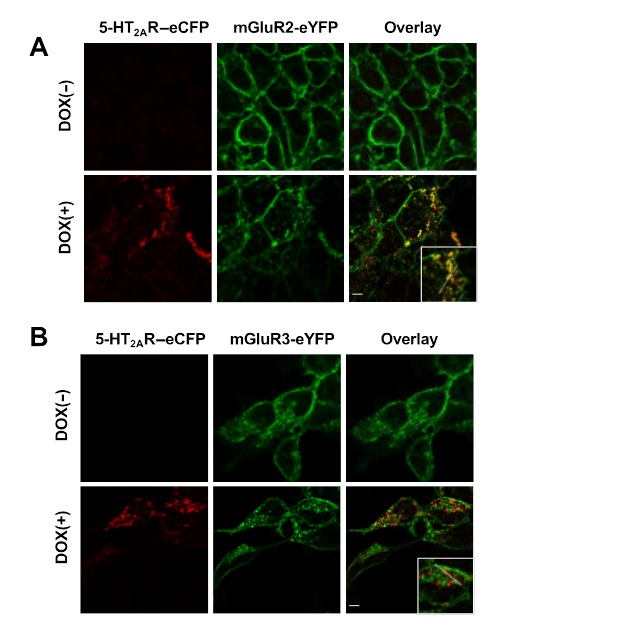
Los procesos de tráfico en membranas celulares regulan la actividad de los receptores acoplados a proteínas G (GPCRs). Aunque los GPCRs de clase A son capaces de activar a las proteínas G de una forma monomérica, también tienen la posibilidad de nsamblarse en heterómeros de receptores funcionales. En este trabajo realizado en la Virginia Commonwealth University en colaboración con investigadores de la Icahn School of Medicine at Mount Sinai y el Instituto de Parasitología y Biomedicina “López-Neyra” del CSIC, describimos que el receptor clase A de serotonina 5-HT2A afecta la localización y el tráfico intracelular del receptor clase C metabotrópico de glutamato mGluR2 a través de un mecanismo que requiere de su ensamblaje en heterómeros en células de mamíferos. El receptor 5-HT2A localiza principalmente en compartimentos intracelulares en ausencia de agonistas, y la coexpresión de éste con el receptor mGluR2 incrementa la distribución intracelular de los receptores mGluR2 localizados anteriormente en la membrana plasmática. Agonistas tanto del receptor 5-HT2A como del receptor mGluR2 afectan de forma diferencial al tráfico intracelular a través de endosomas que expresan la proteína Rab5 en células que expresan cada uno de los componentes del heterocomplejo 5-HT2A-mGluR2 de forma individual como conjunta. Además, el bloqueo farmacológico del recetor 5-HT2A con clozapina, pero no con M100907, disminuye la densidad de los receptores mGluR2 a través de un mecanismo que implica la heteromerización entre 5-HT2A y mGluR2. La expresión de receptores 5-HT2A también aumenta la localización intracelular de los receptores mGluR2 en neuronas piramidales de la corteza frontal de ratón. En conjunto, nuestros datos sugieren que la heteromerización de GPCRs puede representar por sí misma un mecanismo de tráfico intracelular y de ordenamiento de estos receptores.
https://stke.sciencemag.org/content/13/654/eaaw3122.long.
