Sonia García-Rodríguez, Antonio Rosal-Vela, Davide Botta, Luz M. Cumba Garcia, Esther Zumaquero, Verónica Prados-Maniviesa, Daniela Cerezo-Wallis, Nicola Lo Buono, José-Ángel Robles-Guirado, Salvador Guerrero, Elena González-Paredes, Eduardo Andrés-León, Ángel Corbí, Matthias Mack, Friedrich Koch-Nolte, Ramón Merino, Mercedes Zubiaur, Frances E. Lund & Jaime Sancho.
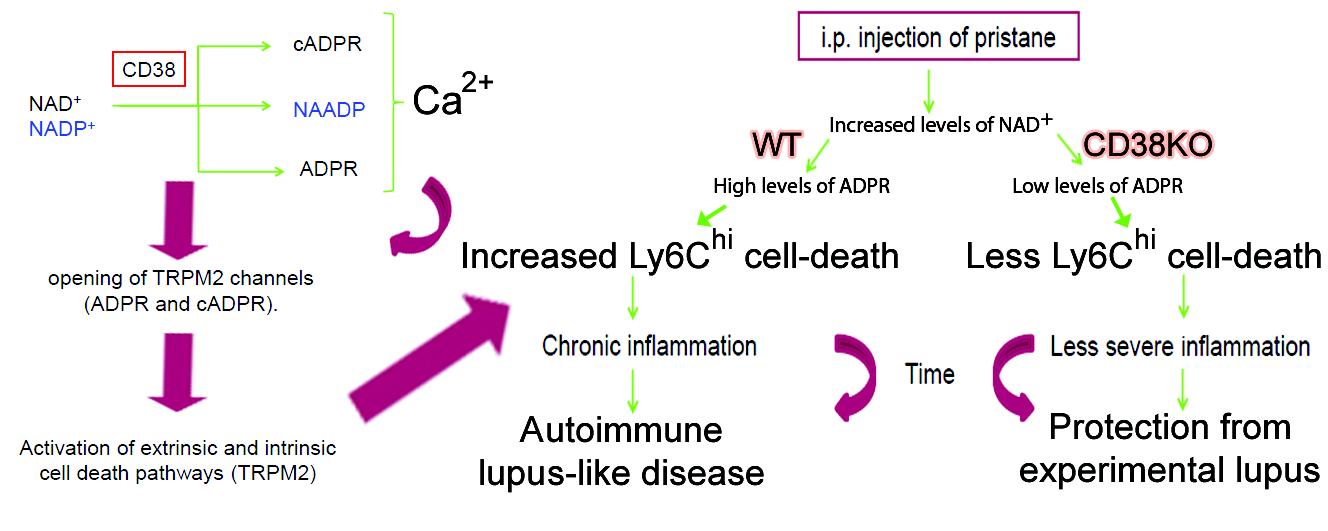
En este trabajo, los grupos del Dr. Jaime Sancho y de la Dra. Mercedes Zubiaur del IPBLN en colaboración con el grupo de la Dra. Frances E. Lund (University of Alabama at Birmingham, UAB), el Dr. Ramón Merino (IBBTEC-CSIC), el Dr. Friedrich Koch-Nolte (University Medical Center Eppendorf-Hamburg, Hamburgo) y el Dr. Ángel Corbí (CIB-CSIC) han utilizado un modelo experimental de lupus eritematoso sistémico para demostrar que CD38 tiene una función primordial en el desarrollo de esta enfermedad autoinmune favoreciendo la muerte celular por apoptosis de los monocitos pro-inflamatorios caracterizados por la alta expresión del marcador Ly6C (Ly6Chi). La muerte por apoptosis se produce por un mecanismo de liberación de calcio intracelular que depende de la producción de ADP-ribosa (ADPR) mediada por la actividad enzimática de CD38 sobre NAD+ y la consiguiente apertura del canal selectivo de cationes TRPM2 (Transient Receptor Potential Melastatin 2) potenciado por la ADPR. El efecto pro-apoptótico de CD38 y TRPM2 en los monocitos Ly6Chi es particularmente deletéreo en este modelo de lupus por la virtual ausencia de macrófagos peritoneales con capacidad fagocítica o anti-inflamatoria en los ratones tratados con pristano. Los macrófagos peritoneales en condiciones normales eliminarían eficientemente los cuerpos apoptóticos y favorecerían la resolución de la inflamación, justo lo contrario de lo que ocurre en el modelo de lupus. En ratones deficientes en CD38 (o TRPM2) la muerte por apoptosis de los monocitos Ly6Chi está significativamente disminuida, así como la inflamación y la enfermedad autoinmune consiguiente. De estos estudios y de otros previos de nuestro laboratorio se deduce que CD38 tiene un enorme potencial para ser utilizado como diana terapéutica con el fin de inhibir la inflamación crónica ligada a autoinmunidad y a la vejez.
Abstract
In this study, we investigated the role of CD38 in a pristane-induced murine model of lupus. CD38-deficient (Cd38−/−) but not ART2-deficient (Art2−/−) mice developed less severe lupus compared to wild type (WT) mice, and their protective phenotype consisted of (i) decreased IFN-I-stimulated gene expression, (ii) decreased numbers of peritoneal CCR2hiLy6Chi inflammatory monocytes, TNF-α-producing Ly6G+ neutrophils and Ly6Clo monocytes/macrophages, (iii) decreased production of anti-single-stranded DNA and anti-nRNP autoantibodies, and (iv) ameliorated glomerulonephritis. Cd38−/− pristane-elicited peritoneal exudate cells had defective CCL2 and TNF-α secretion following TLR7 stimulation. However, Tnf-α and Cxcl12 gene expression in Cd38−/− bone marrow (BM) cells was intact, suggesting a CD38-independent TLR7/TNF-α/CXCL12 axis in the BM. Chemotactic responses of Cd38−/− Ly6Ch monocytes and Ly6G+ neutrophils were not impaired. However, Cd38−/− Ly6Chi monocytes and Ly6Clo monocytes/macrophages had defective apoptosis-mediated cell death. Importantly, mice lacking the cation channel TRPM2 (Trpm2−/−) exhibited very similar protection, with decreased numbers of PECs, and apoptotic Ly6Chi monocytes and Ly6Clo monocytes/macrophages compared to WT mice. These findings reveal a new role for CD38 in promoting aberrant inflammation and lupus-like autoimmunity via an apoptosis-driven mechanism. Furthermore, given the implications of CD38 in the activation of TRPM2, our data suggest that CD38 modulation of pristane-induced apoptosis is TRPM2-dependent.
Scientific Reports | (2018) 8:3357.
DOI:10.1038/s41598-018-21337-6
