|
|
|
|
Instituto de Parasitología y Biomedicina
"López - Neyra" |
|
|
|
|
|
|
[ Personal | Líneas de Investigación | Organismos Financiadores | Publicaciones | Tesis Doctorales | Patentes | Docencia]
|
|
NEUROINMUNOLOGÍA DE ENFERMEDADES INFLAMATORIAS Y AUTOINMUNES
|
Jefatura de grupo- Mario Delgado Mora
email: mdelgado (@ipb.csic.es)
 |
|
Personal Investigador Postdoctoral - Jenny Karina Campos Salinas
- Ignacio Serrano Martínez
|
Personal Investigador Predoctoral - Ana Reyes Blázquez Caraballo
- Marina García Frutos
|
Personal Técnico/Administración - Marta Caro Moreno
- María Gemma Robledo Pérez
|
Personal Autorizado |
|
|
|
LINEAS DE INVESTIGACIÓN
NEUROINMUNOLOGÍA DE ENFERMEDADES INFLAMATORIAS Y AUTOINMUNES
Los diferentes objetivos científicos perseguidos por nuestro grupo de investigación se pueden englobar en el objetivo común de la búsqueda de agentes inmunomoduladores endógenos para el tratamiento de enfermedades inflamatorias y autoinmunes. Esta búsqueda se basa principalmente en el conocimiento de la neuroinmunología de dichas enfermedades. La Neuroinmunología es el campo de la Biomedicina que estudia la comunicación bidireccional que existe entre los sistemas neuroendocrino e inmune. Esta comunicación está basada en un lenguaje bioquímico común, a través de moléculas (citoquinas, neuropéptidos y hormonas) sintetizadas y secretadas por células de ambos sistemas en respuesta a ciertos estímulos, y que a través de receptores específicos expresados en dichas células, regulan de una forma autocrina, paracrina y/o sistémica la fisiología de ambos sistemas. Esta regulación es crucial para el mantenimiento de la homeostasis del organismo. De hecho, cuando se produce agresiones o daños tisulares, como puede ser los debidos a diversos traumas, una infección, una respuesta inflamatoria o una enfermedad autoinmune, el organismo responde secretando muchos de estos mediadores. Por lo tanto, se cree que parte de estos mediadores neuroinmunes participan en uno u otro sentido en la mediación, prevención o reparación de dichos daños. El ejemplo más representativo de estos mediadores neuroinmunes es el de los glucocorticoides, potentes agentes anti-inflamatorios que se producen por activación del eje hipotálamo-hipófisis-adrenal en respuesta a unos niveles altos de citoquinas inflamatorias como consecuencia de una inflamación/infección sistémica.
Basado en este concepto, nuestro grupo se centró en el estudio de varios neuropéptidos, principalmente el péptido intestinal vasoactivo (VIP) y péptidos relacionados (ej. PACAP). Como su nombre indica, VIP es un péptido de 28 aminoácidos que fue aislado por primera vez en el tracto gastrointestinal por su capacidad vasodilatadora, pero que posteriormente fue descrito como un neuropéptido ubicuo con un amplio abanico de funciones en múltiples tejidos. Al poco de su descubrimiento, diversos estudios describieron altos niveles séricos de VIP en pacientes con enfermedades inflamatorias agudas y crónicas, especialmente en choque endotóxico o endotoxemia, una alteración causada principalmente por una infección bacteriana sistémica caracterizada por un infiltración leucocitaria y coagulación diseminada que desencadena un fallo multiorgánico caracterizado por una hipotensión e hipoxia. En ese momento, y debido a su capacidad vasodilatadora, se relacionó los niveles elevados de VIP durante endotoxemia como una posible causa de esta enfermedad. Paralelamente a esto, demostramos que VIP era sintetizado por células del sistema inmune, principalmente linfocitos, en respuesta estimulación antigénica e inflamación, caracterizamos diferentes receptores para VIP y análogos en diferentes células inmunes (principalmente linfocitos y macrófagos), y encontramos que VIP podía regular algunas funciones inmunes, como fagocitosis, adherencia, quimiotaxis, proliferación y producción de radicales libres. Fue entonces cuando empezamos a pensar que habría que mirar los niveles elevados de VIP en pacientes con endotoxemia, así como con artritis reumatoide (RA) o enfermedades intestinales inflamatorias (IBD), no como una causa de dichas alteraciones inmunológicas, sino como una consecuencia de las mismas, y que el organismo respondiera a un estado inflamatorio exacerbado produciendo VIP (junto a otros factores endógenos anti-inflamatorios) en un intento de restaurar un estado inflamatorio normal. En ese momento demostramos que VIP era un potente agente anti-inflamatorio, que afectaba tanto la inmunidad innata como la adquirida. VIP actúa principalmente sobre macrófagos, células dendríticas (DC) y microglía. Macrófagos y DCs en la periferia, y microglía en el sistema nervioso central (SNC) juegan un papel clave en la inmunidad innata, y sirven como enlace con la inmunidad adquirida actuando como células presentadoras de anfígeno (APCs). Estas células son las encargadas de eliminar cualquier patógeno que entre en el organismo, a través de la producción de citoquinas citotóxicas, radicales de oxígeno, y movilizando más células inmunitarias en respuesta a quimioquinas inflamatorias. Por otro lado, las células T CD4 proliferan y se diferencia a células Th1 o Th2 efectoras en respuesta a señales estimuladoras y co-estimuladoras proporcionadas por las APCs.
Cuando concluye la respuesta inmune, tanto las células T y como las APCs tienen que ser desactivadas o eliminadas para evitar un daño tisular excesivo. Nuestro grupo identificó a VIP como uno de los factores endógenos que contribuyen a desactivar esta respuesta inflamatoria. VIP ejerce su efecto anti-inflamatorio a través de diferentes mecanismos: a) inhibiendo por un lado la producción de un amplio abanico de mediadores pro-inflamatorios, como TNF?, IL-6, IL-1?, óxido nítrico, IL-12, IFN?, y varias quimioquinas, y al mismo tiempo estimulando la de citoquinas anti-inflamatorias (IL-10 e IL-1Ra) por macrófagos y microglia activados; b) inhibiendo la expresión de moléculas costimuladoras en macrófagos y DCs, y la consiguiente inhibición de su capacidad activadota de células T; c) inhibiendo la respuesta Th1 (reducción la activación y diferenciación de células Th1). Paralelamente demostramos que los efecto anti-inflamatorios de VIP eran mediados a través de la regulación de varios factores de transcripción que son claves para la síntesis de factores inflamatorios, como NF-kB, MAPK, STAT, JAK, CREB, JNK entre otros.
| |
 |
 |
|
Por otro lado, y relacionado con esta función anti-inflamatoria, demostramos que VIP era principalmente producido por linfocitos T tipo 2 (CD4 Th2 y CD8 T2) en respuesta a una estimulación antigénica específica, y que a través de un feedback positivo, favorecía la respuesta Th2 (anti-inflamatoria), e inhibía la respuesta Th1 (pro-inflamatoria). VIP lleva a cabo este efecto a través de varios mecanismos interrelacionados, que incluyen efectos directos sobre células T CD4 en diferenciación, efectos indirectos sobre APCs, y modulación de la proliferación, supervivencia y reclutamiento de células T efectoras ya generadas. VIP es de los pocos factores endógenos descritos en la inducción de la generación de células Th2 de memoria, un proceso clave para la mejora de la vacunación en humanos.
Llegados a este punto nos planteamos la siguiente cuestión: ¿podríamos considerar a VIP como una citoquina tipo 2, en lugar de un neuropéptido, como tradicionalmente había sido clasificado? Numerosas revisiones escritas hasta este momento en las principales revistas de inmunología parecen indicar que la comunidad científica así lo considera, ya que hemos demostrado que VIP muestra características de citoquinas Th2 como son que es producido mayoritariamente por las células T tipo 2 (principalmente Th2) en respuesta a una estimulación antigénica específica, y ejerce funciones típicas de citoquinas Th2, como son un efecto anti-inflamatorio potente y regulación de la respuesta Th1/Th2 a favor de ésta última.
Desde un punto de vista de un papel fisiológico normal, el hecho de que VIP promueva la generación y supervivencia de células Th2 de memoria es particularmente relevante en vistas al concepto que el inmunoprivilegio, del que gozan órganos como cerebro y ojo, es un proceso activo de desviación inmune mediado por células T reguladoras generadas en presencia de citoquinas Th2. Desde un punto de vista patológico, estos resultados abrieron la posibilidad de usar VIP o sus análogos en el tratamiento de enfermedades inflamatorias y autoinmunes donde la respuesta inflamatoria está exacerbada y existe una predominancia de una respuesta Th1 autorreactiva. En este sentido, y usando modelos de experimentación plenamente establecidos, nuestro grupo ha demostrado claramente el efecto terapéutico de VIP y sus agonistas en varias patologías inmunes:
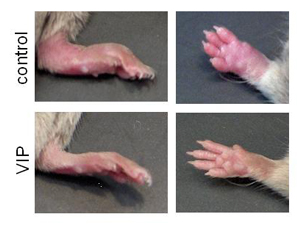
-VIP protege contra la muerte producida por choque endotóxico, reduciendo la infiltración leucocitaria y la coagulación diseminada típica de esta enfermedad, y reduciendo la producción de diversos factores inflamatorios. -VIP protege de la neurodegeneración producida por neuroinflamación en sendos modelos de enfermedad de Parkinson y trauma cerebral, desactivando principalmente a la microglía residente. -la administración de VIP a ratones con artritis reumatoide, con inflamación intestinal aguda (IBD, modelo de enfermedad de Crohn), con diabetes tipo I (ratones NOD), o con encefalomielitis autoinmune experimental (modelo de esclerosis múltiple) inhibe la incidencia y severidad de dichas enfermedades. Este efecto es mediado a través de la supresión de los dos componentes patológicos de dichas enfermedades, una inflamación exacerbada, y una respuesta autorreactiva de tipo Th1 contra el órgano diana correspondiente. En todos los casos, VIP reduce la infiltración de células inflamatorias, principalmente macrófagos, neutrófilos y células Th1 en la articulación, mucosa intestinal, islotes pancreáticos, y cerebro y medula espinal, respectivamente.
El efecto inhibidor de VIP sobre la respuesta inflamatoria y la respuesta Th1 exacerbadas típicas de estas enfermedades autoinmunes explicaba perfectamente su efecto terapéutico sobre las mismas. Sin embargo, recientemente hemos investigado la participación de un mecanismo celular adicional, que viene a sumarse a los anteriormente descritos. Este mecanismo consiste en que VIP es capaz de inducir la generación/activación de células T reguladoras (Treg) específicas de antígeno. Treg son un tipo de células que produce nuestro organismo para mantener un estado de tolerancia inmunológica normal. Un descenso en la cantidad o funcionalidad de estas células provoca unos estados de autoinmunidad generalizados. Nosotros hemos visto que tanto, durante el desarrollo de la enfermedad autoinmune, como en un estado normal del individuo, VIP induce un mayor número de estas células (caracterizadas por un fenotipo CD4+CD25+CTLA4+ y por células tipo Tr1 productoras de IL-10 y TGF?1), y quizás más importante, VIP hace que estas células sean mucho más eficientes realizando su función supresora contra el potencial autoantígeno. Actualmente, estamos estudiando los mecanismos celulares implicados en esta generación de Treg, aunque sabemos que la inducción de células dendríticas tolerogénicas (productoras de IL-10) es uno de los mecanismos implicados.
En estos momentos, la comunidad científica está volcada en conocer los mecanismos y factores que inducen la generación de Treg, ya que se ha visto que se pueden usar terapéuticamente en el tratamiento de varias enfermedades autoinmunes y en el rechazo de transplantes. De este modo, mi grupo ha demostrado recientemente que las Treg y las dendríticas tolerogénicas generadas con VIP inhiben el desarrollo de varias enfermedades autoinmunes (RA, EAE e IBD) y evitan el rechazo de transplantes de médula ósea y la consiguiente muerte a consecuencia de la reacción injerto contra huésped (GVHD), mientras mantienen la capacidad de eliminación del tumor leucémico. Esto ha abierto la posibilidad de terapia celular de estas alteraciones inmunológicas con Treg generadas por VIP, aprovechando un mecanismo natural del organismo para restaurar la tolerancia, y sería una alternativa a la terapia farmacológica con VIP de las mismas.
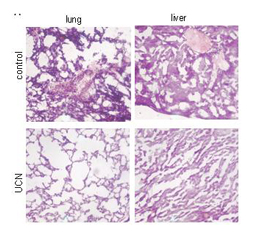
Basado en la estrategia que hemos utilizado para encontrar a VIP como mediador anti-inflamatorio endógeno, más recientemente hemos tratado de buscar otros factores con dicha capacidad para estudiar su actividad anti-inflamatoria y terapéutica en diversas alteraciones inmunes (inflamación y autoinmunidad). En este sentido, tenemos resultados concluyentes que han identificado a adrenomedulina, grelina, urocortina y cortistatina como potentes factores anti-inflamatorios que desactivan macrófagos y monocitos, que inhiben la respuesta Th1, y potencialmente células Treg. Igualmente hemos usado con éxito estos nuevos neuropéptidos en la terapia de choque endotóxico, artritis reumatoide e IBD.
Estos estudios han puesto la base para las directrices futuras de nuestro laboratorio, que van a consistir básicamente en:
- Estudiar los mecanismos implicados en la generación/activación de Treg y células dendríticas tolerogénicas por VIP, investigando sobretodo la activación mediada por NFkB, señalización a través de Toll-like receptor 4 (TLR-4) y MyD88, producción de citoquinas y factores tolerizantes (principalmente CTLA-4, TGFb e IL-10), y la participación de la enzima IDO y el catabolismo de triptófano.
- Ampliar la utilización terapéutica de Treg y dendríticas reguladoras en otras alteraciones autoinmunes y otros tipos de transplantes alogénicos (principalmente piel, corazón y páncreas). Utilización de otros factores tolerizantes (glucocorticoides, vitamina D, TGF, IL-10) en combinación con los neuropéptidos para aumentar la eficiencia/número de Treg.
- Ampliación del uso terapéutico de VIP, adrenomedulina, grelina, urocortina y cortistatina en otras enfermedades autoinmunes como tiroiditis de Hashimoto y miocarditis autoinmune, usando modelos experimentales establecidos. Asimismo, pretendemos extender dicho estudio a la inflamación producida en el SNC, centrándonos sobretodo en la microglía como célula diana. Finalmente, investigaremos el potencial efecto de estos neuropéptidos en la generación de células Treg y su uso terapéutico en autoinmunidad y transplantes.
- Uso de terapia génica con vectores que incluyan neuropéptidos en enfermedades autoinmunes (RA y EAE).
- Investigar el efecto de VIP en otros factores implicados en el desencadenamiento o prevención de la respuesta inflamatoria sistémica. Así, estamos investigando el efecto de VIP y otros neuropéptidos en la producción del factor HMGB-1 en estados inflamatorios agudos, ya que es un factor clave en el desarrollo de la endotoxemia y artritis reumatoide severa. Por otro lado, estamos investigando el efecto de estos neuropéptidos en la producción de la hemoxigenasa-1 (HO-1), una enzima citoprotectora en varios modelos de autoinmunidad, inflamación y transplantes.
- Estamos estudiando el efecto terapéutico de células mesenquimales madre adultas obtenidas de grasa en enfermedades inflamatorias y autoinmunes, basado en un efecto citoreparador y anti-inflamatorio de las mismas, y con una cierta capacidad de restablecimiento de tolerancia inmunológica. Así, hemos demostrado recientemente que la administración de estas células humanas a ratones con IBD o RA, previene del desarrollo de ambas enfermedades, inhibiendo la respuesta inflamatoria y estimulando una respuesta T reguladora, además de su ya descrita acción reparadora de tejidos.
ORGANISMOS FINANCIADORES ÚLTIMOS 5 AÑOS
|
|
- PAPEL DE CORTISTATINA EN LA REGULACION DE LA PNEUMONIA BACTERIANA. PROYECTO, PN2021 - PROY I+D GENERACION CONOC. - PID, Ref: PID2021-127755OB-I00, (2022 - 2024).
|
|
- Nueva estrategia terapéutica para el tratamiento de enfermedades inflamatorias y autoinmunes: células madre mesenquimales versión 2.0 (ASC v2.0). PROYECTO, J.A.- Retos de la sociedad andaluza 2020, Ref: P20_01255, (2021 - 2022).
|
|
- Development of cellular assays to detect altered LRRK2 kinase activity in Parkinson¨s disease.. PROYECTO, INTRAMURAL, Ref: 202120E056, (2021 - 2023).
|
|
- Estudio de la haploinsuficiencia de cortistatina como modelo experimental de monosomia 1p36. PROYECTO, , Ref: 201920E046, (2019 - 2020).
|
|
- PAPEL INMUNOMODULADOR DE CORTISTATINA EFECTO EN FUNCION TIMICA E INMUNOSENESCENCIA. PROYECTO, PN2018 - Proyectos I+D+i «Retos Investigación», Ref: RTI2018-100700-B-I00, (2019 - 2021).
|
|
- ESTUDIO DEL PAPEL DE CORTISTATINA EN FIBROSIS: POTENCIAL APLICACION TERAPEUTICA EN ENFERMEDADES CRONICAS ASOCIADAS A DAÑO TISULAR. PROYECTO, PN2015 - PROY I+D+I - PRG. RETOS DE LA SOCIEDAD, Ref: SAF2015-67787-R, (2016 - 2019).
|
|
PUBLICACIONES ÚLTIMOS 5 AÑOS
|
|
-Chen, Z.; Leceta, J.; Abdul-Sater, A.A.; Delgado, M., Editorial: The innate immune system in rheumatoid arthritis, Frontiers in Immunology, 2022, Vol. 13: 1089522, EDITORIAL, Id:919958 |
|
-Jenny Campos-Salinas; Margarita Barriga; Mario Delgado, Therapeutic Effect of a Latent Form of Cortistatin in Experimental Inflammatory and Fibrotic Disorders, Pharmaceutics, 2022, Vol. 14: 12-2785, ARTÍCULO, Id:915231 |
|
-Cavalcanti, F.; Gonzalez-Rey, E.; Delgado, M.; Falo, C.P.; Mestre, L.; Guaza, C.; O¿valle, F.; Lufino, M.M.P.; Xaus, J.; Mascaró, C.; Lunardi, S.; Sacilotto, N.; Dessanti, P.; Rotllant, D.; Navarro, X.; Herrando-Grabulosa, M.; Buesa, C.; Maes, T., Efficacy of Vafidemstat in Experimental Autoimmune Encepha-Lomyelitis Highlights the KDM1A/RCOR1/HDAC Epigenetic Axis in Multiple Sclerosis, Pharmaceutics, 2022, Vol. 14: 7-1420, ARTÍCULO, Id:905929 |
|
-Barriga, M.; Benitez, R.; Robledo, G.; Caro, M.; O'Valle, F.; Campos-Salinas, J.; Delgado, M., Neuropeptide Cortistatin Regulates Dermal and Pulmonary Fibrosis in an Experimental Model of Systemic Sclerosis, Neuroendocrinology, 2022, Vol. 112: 784-795, ARTÍCULO, Id:903396 |
|
-Paola Alejandra Romecín; Meritxell Vinyoles; Belén López-Millán; Rafael Diaz de la Guardia; Noemi M Atucha; Sergi Querol; Clara Bueno; Raquel Benitez; Elena Gonzalez-Rey; Mario Delgado; Pablo Menéndez, Robust In Vitro and In Vivo Immunosuppressive and Anti-inflammatory Properties of Inducible Caspase-9-mediated Apoptotic Mesenchymal Stromal/Stem Cell, Stem Cells Translational Medicine, 2022, Vol. 11: 88-96, ARTÍCULO, Id:892524 |
|
-Raquel Benitez; Marta Caro; Eduardo Andres-Leon; Francisco O'Valle; Mario Delgado, Cortistatin regulates fibrosis and myofibroblast activation in experimental hepatotoxic¿and cholestatic¿induced liver injury, British Journal of Pharmacology, 2022, Vol. 179: 2275-2296, ARTÍCULO, Id:888782 |
|
-Ana Isabel Sánchez-Castillo; M. Rosario Sepúlveda; José Luis Marín-Teva; Miguel A. Cuadros; David Martín-Oliva; Elena González-Rey; Mario Delgado; Veronika E. Neubrand, Switching Roles: Beneficial Effects of Adipose Tissue-Derived Mesenchymal Stem Cells on Microglia and Their Implication in Neurodegenerative Diseases, Biomolecules, 2022, Vol. 12: 2192-219, ARTÍCULO DE REVISIÓN, Id:870212 |
|
-Barriga, M.; Benitez, R.; Ferraz-de-Paula, V.; Garcia-Frutos, M.; Caro, M.; Robledo, G.; O'Valle, F.; Campos-Salinas, J.; Delgado, M., Protective role of cortistatin in pulmonary inflammation and fibrosis, British Journal of Pharmacology, 2021, Vol. 178: 4368-4388, ARTÍCULO, Id:866715 |
|
-Belmonte-Reche, E.; Peñalver, P.; Caro-Moreno, M.; Mateos-Martín, M.L.; Adán, N.; Delgado, M.; González-Rey, E.; Morales, J.C., Silyl resveratrol derivatives as potential therapeutic agents for neurodegenerative and neurological diseases, European Journal of Medicinal Chemistry, 2021, Vol. 223: 113655, ARTÍCULO, Id:852375 |
|
-Falo, C.P.; Benitez, R.; Caro, M.; Morell, M.; Forte-Lago, I.; Hernandez-Cortes, P.; Sanchez-Gonzalez, C.; O¿valle, F.; Delgado, M.; Gonzalez-Rey, E., The neuropeptide cortistatin alleviates neuropathic pain in experimental models of peripheral nerve injury, Pharmaceutics, 2021, Vol. 13: 7-947, ARTÍCULO, Id:852220 |
|
-Rol, Á.; Todorovski, T.; Martin-Malpartida, P.; Escolà, A.; Gonzalez-Rey, E.; Aragón, E.; Verdaguer, X.; Vallès-Miret, M.; Farrera-Sinfreu, J.; Puig, E.; Fernández-Carneado, J.; Ponsati, B.; Delgado, M.; Riera, A.; Macias, M.J., Structure-based design of a Cortistatin analogue with immunomodulatory activity in models of inflammatory bowel disease, Nature Communications, 2021, Vol. 12: 1-1869, ARTÍCULO, Id:846339 |
|
-Zanetti, S.R.; Romecin, P.A.; Vinyoles, M.; Juan, M.; Fuster, J.L.; Cámos, M.; Querol, S.; Delgado, M.; Menendez, P., Bone marrow MSC from pediatric patients with B-ALL highly immunosuppress T-cell responses but do not compromise CD19-CAR T-cell activity, Journal for ImmunoTherapy of Cancer, 2020, Vol. 8: , ARTÍCULO, Id:813117 |
|
-de la Guardia, R.D.; Lopez-Millan, B.; Roca-Ho, H.; Bueno, C.; Gutiérrez-Agüera, F.; Fuster, J.L.; Anguita, E.; Zanetti, S.R.; Vives, S.; Nomdedeu, J.; Sackstein, R.; Lavoie, J.; Gónzalez-Rey, E.; Delgado, M.; Rosu-Myles, M.; Menendez, P., Bone marrow mesenchymal stem/stromal cells from risk-stratified acute myeloid leukemia patients are anti-inflammatory in in vivo preclinical models of hematopoietic reconstitution and severe colitis, Haematologica, 2019, Vol. 104: e54-e58, CARTA AL EDITOR, Id:744444 |
|
-Neubrand, V.E.; Forte-Lago, I.; Caro, M.; Delgado, M., The atypical RhoGTPase RhoE/Rnd3 is a key molecule to acquire a neuroprotective phenotype in microglia 06 Biological Sciences 0601 Biochemistry and Cell Biology, Journal of Neuroinflammation, 2018, Vol. 15: 1-343, ARTÍCULO, Id:739307 |
|
-Benitez, R.; Delgado-Maroto, V.; Caro, M.; Forte-Lago, I.; Duran-Prado, M.; O¿Valle, F.; Lichtman, A.H.; Gonzalez-Rey, E.; Delgado, M., Vasoactive intestinal peptide ameliorates acute myocarditis and atherosclerosis by regulating inflammatory and autoimmune responses, Journal of Immunology, 2018, Vol. 200: 3697-3710, ARTÍCULO, Id:723202 |
|
-Pablo Peñalver; Efres Belmonte-Reche; Norma Adán; Marta Caro; María Luisa Mateos-Martín; Mario Delgado; Elena González-Rey; Juan Carlos Morales, Alkylated resveratrol prodrugs and metabolites as potential therapeutics for neurodegenerative diseases, European Journal of Medicinal Chemistry, 2018, Vol. 146: 123-138, ARTÍCULO, Id:713336 |
TESIS DOCTORALES ÚLTIMOS 5 AÑOS
2022 |
|
Raquel Benitez Gil
"Análisis del papel del neuropéptido cortistatina en fibrosis hepática"
Instituto de Parasitología y Biomedicina "López-Neyra" CSIC
| |
| |
2021 |
|
Margarita Barriga García-Mauriño
Papel de Cortistatina en fibrosis crónica: potencial aplicación terapéutica en esclerodermia y fibrosis pulmonar idiopática
IPBLN CSIC
| |
| |
| |
|
|
|
|
Sede: Parque Tecnológico de Ciencias de la Salud, Avda. del Conocimiento, 17. 18016 Armilla (Granada)(ESPAÑA). TEL:+34 958181621. FAX:+34 958181633 |
|
|
|
|
| |
|
Resolución mínima: 1024 x 768 |
Navegadores:Internet Explorer 6.0 / Netscape 7.01 / Mozilla 1.3a / Opera 7.54 |
|

|
|
|
